La lecture, ces jours derniers, de plusieurs publis scientifiques récentes me replonge dans une certaine perplexité à propos des résultats analytiques liés au phosphore dans les sols. Au delà des résultats, ce sont plutôt les méthodes analytiques et la chaîne de mesure, depuis le prélèvement de terre jusqu’à l’interprétation, qui provoquent chez moi ces réactions, on ne se refait pas ! Comme le phosphore est l’un des éléments fondamentaux pour la croissance des végétaux, c’est aussi l’un des enjeux forts en matière de détermination analytique et forcément un levier économique puissant pour les vendeurs d’engrais. Du coup, j’en profite pour faire un petit tour des incertitudes et erreurs qui subsistent dans le domaine de l’analyse de cet élément. Que peut-on doser en routine au laboratoire ? Le phosphore « minéral » par des attaques acides comme la plupart des éléments traces et le phosphore qualifié d' »assimilable », c’est à dire une somme d’anions divers plus ou moins dissous dans la solution du sol et considérés comme plus ou moins accessibles aux plantes. Le phosphore organique n’est en général pas inclus dans les menus de détermination, ce qui pose un léger problème quand on sait que l’on estime son importance relative comprise entre 20% et 80% du phosphore du phosphore total dans les horizons de surface des sols. En ce qui concerne le phosphore assimilable, c’est ce « plus ou moins » (soluble et accessible) qu’il faut retenir en priorité. Car l’analyse du phosphore dit « assimilable » et son interprétation sont entâchés d’erreurs et d’incertitudes, en général maîtrisées ou connues (c’est de la chimie quand même) mais pas forcément évoquées sur les bulletins de résultats.
On peut distinguer cinq niveaux d’erreur à propos de cette détermination et de son utilisation :
1- La première est liée au prélèvement d’échantillon lui-même. L’échantillon est rarement composite et même s’il l’est, donc en parfait accord avec les normes de prélèvement, il faut se rappeler qu’il faut moins de 20g d’un échantillon de sol séché pour réaliser l’analyse avec la plupart des normes. Par ailleurs, l’élément est particulièrement peu mobile dans les sols et toute hétérogénéité liée aux apports, aux divers phénomènes engagés par les racines, aux itinéraires culturaux, ne pourra en général pas être appréciée à sa juste valeur.
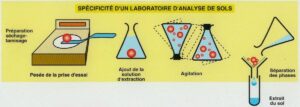
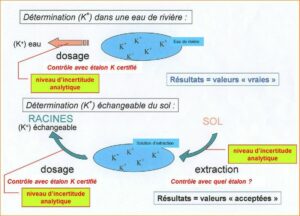
2- La conception d’une analyse de sol induit elle-même un biais initial : lorsque l’on dose le phosphore ou n’importe quel autre élément dans un échantillon de terre, on oublie très souvent de préciser qu’il existe une phase initiale d’extraction de l’élément avant la phase de dosage au sens strict. Or, il n’existe pas d’autre étalon pour contrôler cette phase qu’un échantillon de sol que l’on qualifiera d’étalon interne, dont la valeur de concentration en l’élément donné est calculée sur une base statistique : de ce fait, les résultats sont dans tous les cas des valeurs acceptées et non pas des valeurs vraies. Au contraire, on dispose bien d’étalons certifiés pour contrôler le dosage du phosphore une fois qu’il est mis en solution, donc une fois qu’il est extrait de l’échantillon. Cette deuxième phase de l’analyse est donc mieux maîtrisable, comme n’importe quel dosage chimique. Les petits schémas ci-dessous explicitent ces niveaux d’incertitude avec le potassium comme exemple ; j’ai été flemmard, je ne l’ai pas refait pour le phosphore mais le principe est exactement le même.
Extraction préalable au dosage : spécificité de l’analyse de sol (source : GEMAS)
Niveaux d’incertitude spécifiques à l’analyse de sol
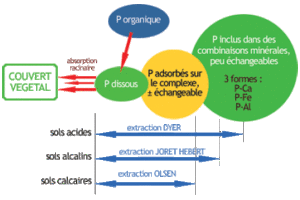
3- Par ailleurs, il existe plusieurs méthodes d’extraction du phosphore, donnant des résultats variables, en général non comparables. Ces méthodes s’appuient sur des concepts chimiques de solubilité ou de disponibilité de l’élément dans des conditions physico-chimiques données : par exemple, en sol plutôt acide ou plutôt alcalin etc. Chaque méthode tente de reproduire l’action de la racine sur son milieu ; ces actions étant elles-mêmes diverses, on comprend alors qu’il n’est pas possible d’utiliser une seule méthode pour cerner toutes les possibilités dont dispose la racine pour s’alimenter, ce qui multiplie les manips à faire, pour autant que lesdites manips permettent de balayer toute la gamme des mécanismes mis en oeuvre par les racines (et d’ailleurs, ce n’est pas le cas). En outre, en France, trois méthodes seulement sont agréées par le Ministère de l’Agriculture, c’est à dire que trois méthodes d’extraction seulement font l’objet d’une procédure de contrôle inter-laboratoires et sont donc assorties des trois mamelles de la qualité – justesse, fidélité, validité- : il s’agit des méthodes Dyer, Joret-Hébert et Olsen.
- La méthode Dyer (norme NF X31-160) est la plus agressive : elle utilise comme réactif d’extraction une solution d’acide citrique à 2% et à pH 2. Elle donne les résultats les plus élevés pour un même échantillon de sol (10g de sol séchés et tamisés à 2mm sont suffisants) parmi les trois méthodes. Elle est en général souvent utilisée en milieu agricole car bien maîtrisée, avec un réactif stable et un référentiel connu (cf paragraphe ultérieur) et elle est plutôt admise comme méthode satisfaisante en sols acides à neutres. En outre, le fait que la méthode soit agressive lui confère une amplitude d’incertitude plus faible. Mais a-t-elle tendance à surestimer la teneur réelle en P assimilable ?
- La méthode Joret-Hébert (norme NF X31-161) consiste en une extraction à l’oxalate d’ammonium à 0.2N en milieu neutre. Elle est considérée comme satisfaisante en sols calcaires à neutres ; pour un même échantillon (ici, 2g de sol séchés et tamisés à 2mm sont suffisants), elle donne des résultats inférieurs à ceux obtenus avec la méthode Dyer, en gros de l’ordre d’un tiers inférieur. Elle est cependanty assortie d’une incertitude de même ampleur relative que celle de la méthode Dyer.
- La méthode Olsen (NF ISO 11263) est très fréquemment utilisée en milieu scientifique ; elle est aussi la plus récemment admise dans les menus de l’agrément du Ministère de l’Agriculture (moins de 10 ans). Elle utilise comme réactif d’extraction une solution de bicarbonate de sodium 0.5N à pH 8.5, c’est à dire qu’il s’agit d’une extraction plutôt ménagée (extraction sur 2,5g de sol séchés et tamisés à 2mm). Elle est considérée comme donnant des résultats satisfaisants pour une large gamme de sols même si elle fut mise au point pour les sols calcaires, mais les valeurs obtenues sont en général faibles, beaucoup plus faibles qu’avec les deux autres méthodes pré-cités, ce qui est normal compte-tenu du réactif. Cependant, cet aspect ménagé est aussi l’un de ses points faibles : d’une part il faut très fréquemment renouveler la solution d’extraction, ce qui peut vite devenir onéreux, et d’autre part, le circuit d’agrément a montré que les laboratoires qui effectuent cette analyse en routine avaient beaucoup de mal à obtenir des résultats reproductibles et convergents ; cette méthode est donc restée longtemps en dehors de l’agrément officiel du fait de cette difficulté. Si l’on note désormais une meilleure convergence entre laboratoires, il faut aussi rappeler que les résultats obtenus sont faibles et assortis d’une amplitude de variation importante : il est donc plus simple de donner un résultat inclus dans la fourchette des valeurs acceptées entre laboratoires puisque l’incertitude admise est importante.
Amplitudes approximatives d’action des trois méthodes, sans respect d’échelle pour les tailles de compartiment !
D’autres méthodes sont utilisées en France, mais ne sont pas soumises aux procédures d’agrément : on peut citer l’extraction à l’eau, la méthode Truog, la méthode Bray I ou bien la méthode Duchaufour par exemple. Cette dernière est intéressante car elle utilise une double extraction successive, d’abord à l’acide sulfurique 0.4N (deux fois) puis à l’hydroxyde de sodium 0.1N, sur le même volume d’échantillon initial. Cette méthode est utilisée principalement en domaine forestier et son concept se rapproche le plus des diverses actions d’une racine, avec entre autres l’extraction probable de P organique ; elle donne des résultats en général supérieurs à ceux obtenus avec la méthode Dyer, sauf dans certains types de sols (pour plus de précisions, lire Bonneau et al. 2003) ; mais elle est difficile à maîtriser et tous les laboratoires n’utilisent en outre pas exactement le même protocole (notamment au niveau de l’extraction acide).
4- Une fois extrait, le dosage du phosphore s’effectue souvent en laboratoire par le biais d’une spectrocolorimétrie à 825nm après développement de la couleur du complexe phosphomolybdique, en comparaison d’une gamme étalon de teneurs en phosphore. Toutefois, la plupart des laboratoires utilisent la technique de l’analyse en flux continu pour optimiser les dosages ; il s’agit en fait de réaliser de façon automatisée une série de dosages sur des échantillons injectés les uns après les autres dans un circuit qui assure lui-même les ajouts de réactifs, les bain-marie, la lecture optique etc. Le contrôle de la manip est alors réalisé en insérant des témoins au sein des séries d’échantillons à doser : une série type serait par exemple la gamme étalon, puis 10 échantillons de teneur inconnue, deux échantillons témoin, 10 échantillons de teneur inconnue etc. La lecture des témoins et de la ligne de base permet de savoir si l’analyseur dérive ou si une erreur a été commise ; mais ce contrôle ne concerne bien évidemment que les témoins : si la manip de dosage rate entre les échantillons témoins, (erreur de pipetage, problème de bullage, problème d’ajout de réactif etc.), les dosages des échantillons inconnus placés entre ces témoins seront malgré tout validés, bien qu’ils soient éronnés. Cela paraît a priori impossible, mais j’ai malheureusement pu le vérifier de nombreuses fois : la technique n’est pas parfaite, des ratés opérationnels sont toujours possibles. Enfin, comme dans tout dosage chimique, le résultat doit être accompagné d’une erreur sur la mesure qu’il est assez simple à mesurer.
gros plan sur les petites tubulures d’un analyseur en flux continu de l’ancien labo Agrosol
Exemple d’une suite d’échantillons dans un analyseur en flux continu. La courbe enregistreur est une représentation schématique de la sortie calculée en temps réels par les analyseurs : à chaque échantillon, un pic plus ou moins important selon la valeur de teneur en P.
Donc, la lecture d’un bulletin d’analyse de sol devrait toujours être assortie d’une réflexion autour de la méthode utilisée, de sa pertinence, de sa représentativité, de sa maîtrise par le laboratoire (les bien connus critères de justesse, fidélité etc.! qui justifient de confier son échantillon à un labo agréé pour l’élément à doser). En caricaturant un peu, un même échantillon (issu d’un sol agricole) pourrait donc donner des teneurs en phosphore « assimilable » de 150mg/kg de terre sèche (exprimé en P2O5) avec la méthode Dyer, 90 à 100mg/kg TS en méthode Joret-Hébert et 50mg/kg TS en méthode Olsen, cette dernière avec une incertitude de l’ordre de +/- 20mg/kg (et encore, je ne suis pas trop méchant !).
A ce stade, on peut être confronté à des résultats obtenus grâce à des méthodes non comparables entre elles, à l’aide de techniques dont le contrôle qualité est en grande partie effectué sur des témoins et pas sur les échantillons eux-mêmes, les témoins proposant en outre des valeurs « acceptées » et non pas « vraies ». Le tout à partir d’un échantillon qui doit être représentatif d’une parcelle.
5- Le dernier niveau d’erreur que l’on peut citer est lié au référentiel utilisé pour interpréter les résultats. Comme les méthodes d’extraction ne sont pas comparables, il faut aussi qu’elles soient accompagnées de référentiels d’interprétation adaptés : un référentiel pour le Dyer, un autre pour le Olsen etc. Sur un bulletin d’analyse, il faut donc avoir suffisamment confiance dans le laboratoire pour accepter l’interprétation qui est faite du dosage du phosphore ; imaginez par exemple que le référentiel utilisé pour une analyse Olsen soit celui du Dyer : comme les résultats obtenus à l’aide de la méthode Olsen sont toujours beaucoup plus faibles que ceux obtenus par la méthode Dyer, le sol serait systématiquement considéré comme carencé en phosphore. Un comble pour l’agriculteur et pour sa gestion des intrants. En outre, certaines méthodes étant très ménagées donc avec une incertitude élevée, il faut envisager que l’interprétation soit elle aussi assortie d’une certaine souplesse et, ce, d’autant plus que le résultat obtenu se rapproche de l’une des bornes de l’interprétation.
Tout cela ne signifie pas qu’un dosage de phosphore dans un sol ne sert à rien ; cela signifie qu’il faut garder un regard critique sur les résultats des analyses qui figurent sur les bulletins et travailler le plus possible en mode relatif. L’incertitude n’est jamais figurée sur un bulletin d’analyse de sols (à ma connaissance), comme dans le cas d’ailleurs des résultats des sondages qui nous sont dispensés en ce moment.
Une solution alternative, sans doute la meilleure mais aussi certainement plus contraignante ? Mesurer le phosphore biodisponible et non pas le phosphore dit « assimilable » que l’on peut aussi rattacher plus simplement au phosphore disponible. Le phosphore biodisponible intègre précisément la notion d’actions racinaires, aux mécanismes et conséquences multiples, et son indicateur le plus pertinent est la plante elle-même ; autrement dit, connaître le plus justement possible les teneurs en phosphore qu’une plante est susceptible d’absorber à partir du sol nécessite d’utiliser la plante comme outil de mesure. C’est possible à l’aide de petits dispositifs (j’en parlerai plus tard) mais c’est aussi un peu plus long.